2021-12-17 13:33 | 來源:中國網財經 | 作者:俠名 | [科創板] 字號變大| 字號變小
新通藥物計劃采用科創板第五套上市標準申請上市,但公司上市前的增資估值低于該標準規定的“預計市值不低于人民幣40億元”的要求。......

西安新通藥物研究股份有限公司(“新通藥物”)向上交所科創板發起沖擊,上市申請于12月6日獲受理。
記者梳理發現,新通藥物成立21年來,因無核心產品實現商業化生產和銷售,目前仍處于虧損階段,近三年凈虧已達2.63億。
另外,新通藥物計劃采用科創板第五套上市標準申請上市,但公司上市前的增資估值低于該標準規定的“預計市值不低于人民幣40億元”的要求。
對此,中國網財經致函新通藥物,截止發稿,未收到任何回復。
三年凈虧2.63億無核心產品商業化
有媒體報道稱,根據招股書披露,在2020年10月的增資中,北京阜瑞、高明、山東科創、西高投、峨勝集團對新通有限進行增資,價格為64.76元/注冊資本,由此測算新通有限當時的投后估值約為30億元,低于科創板第五套上市標準要求的40億元。此外,2020年12月新通有限兩位股東漢富璟晟與潤耀輝華進行了股權轉讓,當時的估值為不到25億元,也明顯低于40億元。
資料顯示,新通藥物成立于2000年5月30日,是一家專注藥物研發的高新技術企業,現聚焦于慢性乙肝、肝癌、癲癇等重大疾病領域。
此次IPO擬募集資金12.79億元,其中近七成用于新藥研發項目,其余3成用于創新藥物產業化生產基地建設項目以及補充流動資金。
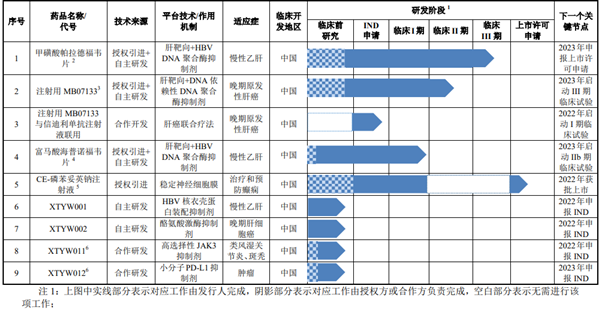
不過,記者注意到,公司9款在研項目中,只有CE-磷苯妥英鈉注射液、富馬酸海普諾福韋片、注射用MB07133和甲磺酸帕拉德福韋片分別處于上市許可申請、臨床I期、臨床II期和臨床III期臨床階段,而其余5款產品還未進入臨床。目前公司并無核心產品實現商業化生產和銷售。
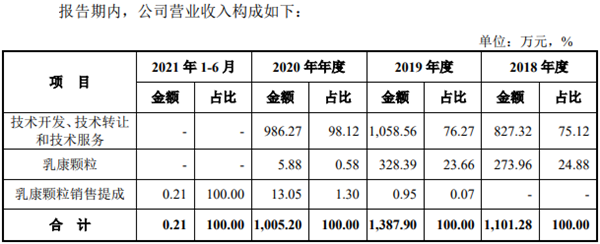
數據顯示,2018年-2021年上半年,公司分別實現營收1101.28萬元、1387.90萬元、1005.20萬元及0.21萬元,主要依靠技術服務、技術轉讓和技術開發相關項目的服務收入及乳康顆粒的銷售收入。其中依靠銷售乳康顆粒獲得的收入分別為1101.28萬元、1387.90萬元、1005.20萬元和0.21萬元。
值得注意的是,2019年新通藥物向千禾藥業轉讓乳康顆粒專利及新藥證書,2020年除了銷售庫存商品之后不再進行乳康顆粒的生產,這也導致2021年上半年新通藥物收入僅2085.52元。
缺少造血的新通藥物只能依靠政府補助、稅反和對外融資等途徑獲得資金。報告期內,新通藥物政府補助金額分別為1440.28萬元、916.54萬元、414.28萬元和413.88萬元。
然而,盡管政府補助可為公司緩解些許壓力,但也只是稍解“燃眉之急”,營運資金仍然承壓。
報告期公司經營現金流凈額分別為-2324.79萬元、-6102.57萬元、-7677.05萬元和-2691.28萬元。2019年由于新通藥物收到的政府補助減少1326.03萬元,收到的稅收返還減少203.93萬元,該年公司現金流凈額同比下降了162.50%;2020年公司注射用MB07133研發項目進入臨床II期試驗;甲磺酸帕拉德福韋得研發進入III期臨床試驗又進一步增加了臨床費用支出,新通藥物該年現金流量凈額較2019年下降25.80%。
招股書顯示,報告期新通藥物的歸母凈利潤分別為-3070.61萬元、-1.11億元、-8745.50萬元和-3315.44萬元,扣非后歸母凈利潤分別為-4967.22萬元、-4273.74萬元、-9842.04萬元和-4030.19萬元。截至2021年上半年,新通藥物累計未彌補虧損達1.05億元。
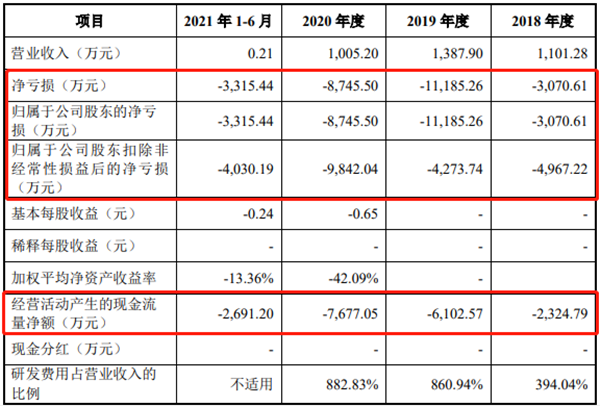
然而在業績持續虧損并預計未來將繼續虧損的情況下,新通藥物仍投入大量資金用于產品管線的臨床前研究、臨床試驗及新藥上市前準備。2018年、2019年、2020年及2021年1-6月,公司研發費用分別為4,339.49萬元、11,948.97萬元、8,874.23萬元和3,033.96萬元,累計達2.82億元。
對此,新通藥物表示,新藥研發需要大量持續的研發投入以及由于股權激勵產生的股份支付費用。隨著公司更多在研藥品進入臨床試驗階段、現有臨床試驗的繼續推進以及未來產品的商業化推廣,未來幾年將存在持續大規模的研發投入。
部分專利為授權獲得“licencein”模式不等于創新
不過,高額的研發費用支出并不意味著高額回報,一款新藥的變現過程漫長而充滿不確定性。曾有統計稱,一個原創新藥最后成為商品正式投入市場的成本超過10億美元,大約花費約10年時間,藥物篩選的失敗率高達97%。
據了解,目前新通制藥進展最快的在研產品——CE-磷苯妥英鈉注射液是一款依托磺丁基-β-環糊精鈉(商品名:Captisol?)包合技術的改良型磷苯妥英鈉注射液,用于治療全身強直一陣孿性癲癇持續狀態,預防和治療神經外科圍手術中引起的癲癇發作。
新通藥物表示,該產品有望成為中國首個獲批預防和治療神經外科圍手術期和手術中引起的癲癇發作適應癥藥品。
記者注意到,這款產品的技術來源于合作方授權,是新通藥物向Sedor公司引進的產品,為磷苯妥英鈉注射液的改良型藥物,作為2.2類新藥申請IND。由于Sedor公司的同類產品已于2020年11月由FDA批準在美國上市,據相關法規,在申報許可上市時按化學藥三類申報。
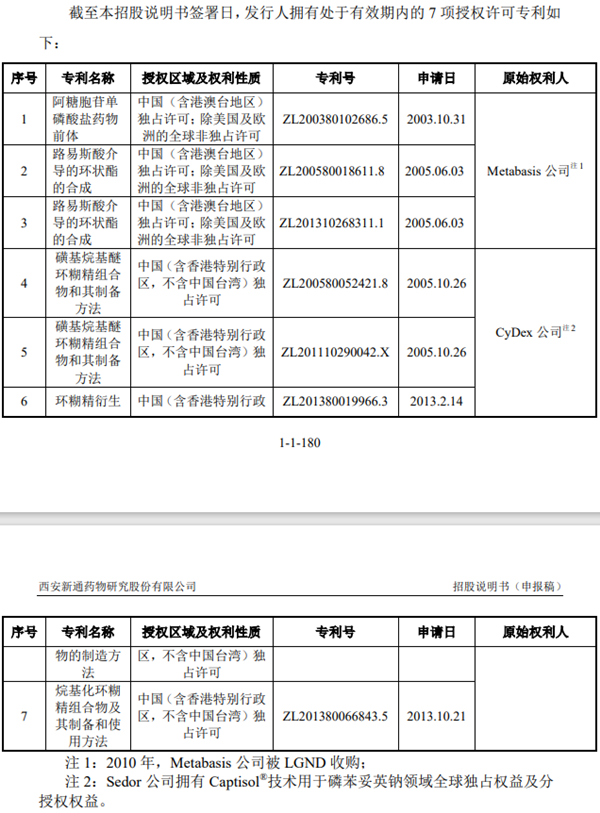
根據新通藥物與美國Sedor公司2017年6月簽署的《許可與分許可協議》顯示,Sedor公司擁有CyDex公司Captisol?藥物配制系統用于CE-磷苯妥英鈉注射液的全球獨占許可,Sedor公司授予發行人對于Captisol?藥物配制系統(分許可知識產權及Captisol數據包)在中國(含香港特別行政區,不含中國臺灣)用于CE磷苯妥英鈉注射液的獨占許可。
同樣的,公司另一款核心在研產品甲磺酸帕拉德福韋片項目在新通藥物引進前已由Metabasis公司在美國完成了II期臨床試驗,后由凱華公司(新通藥物于2015年收購的全資子公司)于2011年1月引進。產品授權引進后公司開展臨床前藥學研究,補充了臨床前安全性研究,并按照原CFDA的法規要求在中國對其進行了臨床試驗,已完成I期、II期臨床試驗,目前正處于III期臨床試驗階段。
除此之外,注射用MB07133在公司引進前也由Metabasis公司在美國完成了I期臨床試驗、富馬酸海普諾福韋片在引進前,其化合物專利同樣系Metabasis公司擁有。
另治療類風濕關節炎、斑禿的XTYW011和腫瘤適應癥XTYW2兩款處于臨床前研究的藥物系新通藥物與中國藥科大學的合作研發項目。雙方約定共同完成臨床前研究,后續工作將由新通藥物完成。
截至招股書發行前,新通藥物已取得17項發明專利,7項授權許可專利,其中三項來自Metabasis公司、四項來自CyDex公司,涉及核心產品。
從研發管線來看,新通藥物是一家典型的“licencein”公司,即授權引進,“產品引進方”向“產品授權方”支付一定的首付款,并約定一定金額的里程碑費用(按品種開發進展)以及未來的銷售提成,從而獲得產品在某些國家(地區)的研發、生產及銷售的商業化權利。
“licencein”無疑是快速學習國外成果的窗口,曾風靡整個醫藥市場。不過近年,資本市場有聲音“科創板開始對Licensein模式的生物醫藥企業從嚴審查。”
據此前科創板發審經驗顯示,如果生物醫藥企業有大量的licensein管線,那么“科創屬性”將在企業上市問詢中被重點關注。在CDE強調“臨床價值”后,甚至曾有一批以licensein為主要模式的生物醫藥企業被攔在了科創板的大門之外。
記者注意到,今年9月,上市委連續否決了兩家生物醫藥企業,分別是海和藥物、吉凱基因。其中,海和藥物被質問“引進或合作開發的核心產品是否獨立自主進行過實質性改進、對合作方是否構成技術依賴”;吉凱基因則被問“核心技術是否具有先進性”。
同類藥物已進“4+7城市藥品集采”內卷再度加劇
作為一家專注于慢性乙肝、肝癌、癲癇等重大疾病領域治療的創新藥企業,新通藥物一方面面臨著專利到期的“內憂”,一方面面臨同類藥品、技術升級、產品迭代的“外患”。
招股書顯示,新通藥物核心在研產品甲磺酸帕拉德福韋片、富馬酸海普諾福韋片的化合物結構的中國專利已于2020年3月3日到期,而其研發進展仍分別處于臨床Ⅲ期、臨床Ⅰ期;注射用MB07133的化合物結構的中國專利將于2023年10月31日到期,研發進展處于臨床Ⅱ期;CE-磷苯妥英鈉注射液藥品組合物專利將于2036年到期,目前處于上市許可申請。
根據《中華人民共和國藥品管理法實施條例》對批準生產的新藥設置了最長5年的新藥監測期規定,在這一期間,該制度將有效的阻止仿制藥的上市。
值得注意的是,由于Sedor公司的同類產品已于2020年11月由FDA批準在美國上市,據相關法規,CE-磷苯妥英鈉注射液在申報許可上市時按化學藥三類申報。而化學藥三類藥物不適用于“新藥監測期”制度。
“專利到期”意味著“相關仿制藥誕生”,將進一步加劇市場競爭,或導致公司調低現有產品價格。
另一方面,“外患”亦在不斷給公司施壓。招股書顯示,公司的核心產品甲磺酸帕拉德福韋片、富馬酸海普諾福韋片屬于依托肝靶向創新藥物研發平臺研發的治療慢性乙肝的1類創新藥。
記者注意到,目前已有恩替卡韋片(ETV)、富馬酸替諾福韋二吡呋酯片(TDF)、富馬酸丙酚替諾福韋片(TAF)、艾米替諾福韋片(TMF)等多款同類藥物在國內獲批上市銷售,并有多個同類藥物處于不同的臨床試驗階段。
并且ETV、TDF已被納入4+7城市藥品集中采購目錄及聯盟地區藥品集中采購目錄,相關藥物銷售價格大幅下降。而在乙肝治療領域,ETV、TDF與甲磺酸帕拉德福韋片、富馬酸海普諾福韋片存在競爭關系。
同樣的,公司另一款產品注射用MB07133屬于依托肝靶向創新藥物研發平臺研發的二線治療晚期肝細胞癌的1類創新藥。
目前,已有瑞戈非尼、PD-1單抗(替雷利珠單抗注射液和注射用卡瑞利珠單抗等)、阿帕替尼等多款同類藥物在國內獲批上市銷售,并有多個同類藥物處于不同的臨床試驗階段。
對此,新通制藥在招股書中坦言,若公司在研藥品相關領域出現突破性進展,或公司藥物治療領域內誕生更具競爭優勢的創新藥物,公司在研產品可能面臨被市場淘汰、失去商業價值的風險,從而對公司的持續盈利能力產生重大不利影響。
《電鰻快報》
相關新聞